高值耗材带量采购--质量评价讨论
一、 背景
1、药品国家层面,VBP已经进行了三批一百多个通用名,降价效果和落地执行成果显著。与药品不同,医疗耗材集采在这两年里多以地方试点,旨在为国家积攒经验教训。
目前,从国家层面来看,冠脉支架铂/钴铬合金雷帕霉素支架集采已进入征求方案阶段,但后续进展似有所阻滞延迟。
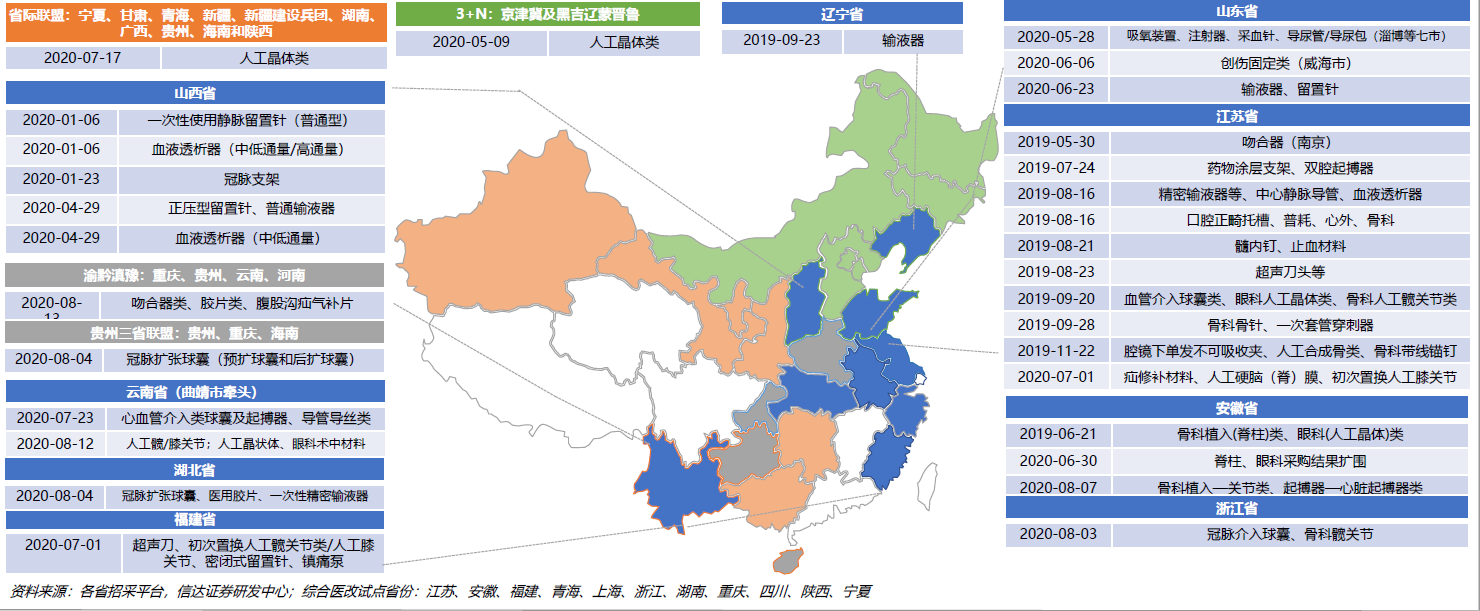
从地方层面来看,目前江苏、福建、安徽等已逐步形成制度化的招采节奏。京津冀3+N的9省联盟、陕西省际联盟、重庆四省联盟、云南 、湖北、福建、浙江单省也开始进行探索,山东省、江苏则进行了以地市级为主体的多品种的采购。
2、由于耗材和药品在产品属性、销售方式、评价手段等存在诸多不同,使得耗材VBP面临与药品不同的问题:
产品分类:药品分类规范、清晰,有权威的版本。耗材分类复杂,从国家医保局多达32,554个医保医用耗材代码,9,404,543个医用耗材实际规格就能看出来,而且目前没有多角度能够统一适用的分类方式;
销售方式:药品基本直销,耗材大多通过经销商,需要渠道商对高值耗材承担基本培训、调试、维修等服务(例如维修免费,但工具往往都很贵,企业承担);
集采中标:药品一致性评价已经逐渐成熟和有权威性,但耗材还没有质量评价体系。药品采购量内独家中标,耗材因客观因素,往往需多家中标,实际量难保证,终端还存在竞争。
患者感受:药品基本是中长期使用,费用敏感度高,按比例报销,对医保的依赖重。耗材多数是一次性使用,尤其是植入产品,患者趋向使用更优质的产品,部分耗材执行定额报销,对医保敏感度不高;
使用难度:药品处方开具后对医生几乎无依赖,使用过程简单。耗材使用多在外科,耗材的使用对医生依赖程度高,使用过程复杂需要不断练习学习,特异性强。
市场环境:药品市场和企业规模大,耗材领域市场相对小、专业集中度高,同一领域内企业基本三~五家主导。
更新换代:药品用量巨大,换代慢。耗材相对用量相对小,产品更新却高的多。
综合以上,在药品VBP中取得成功的要素之一“一致性”评价,在医疗耗材领域难以推行。质量分级只能通过临床数据、医生评价以及产品材料进行质量区分。一个医疗器械产品的成熟不仅需要深厚的技术积累,还需要相当时间的市场培育来得到用户的认可。一种新器械的使用不仅要求医生能够理解和处方,还要求医生具备相应的诊断和手术操作水平以确保产品应用效果,而各级医院的医师水平参差不齐,因此对培训和服务的要求更高。
二、 耗材VBP如何区分质量
从中国耗材采购现状来看,耗材在质量分组方面主要有四种方式:
1、以国产和进口区分; 如,江苏第一批支架,福建VBP;
2、按价格分,江苏支架按以万元上下分组;
3、按市场份额区分; 如,福建以采购数量占比大于7%分组;
4、以产品功能分;如,人工晶体3+N的 53个分组创新了分组方式;
其中1、2,是比较常见的,也是一直以来的惯常分法;比如,从江苏VBP一二三批中我们能看到,对产品均进行了质量分组评价,同时针对不同的产品,也采取了不同的分组方式。
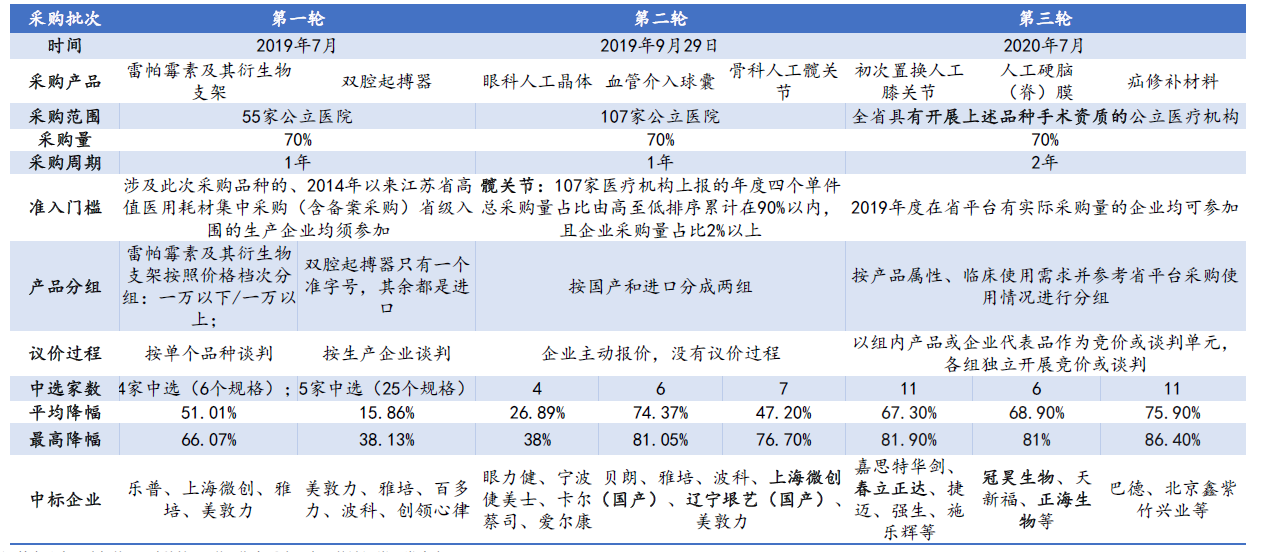
总体上看,似乎分类方式多且杂,没有形成有效且统一的分类方式。那么目前耗材集采产品质量分层或者说质量评价难点在哪呢?
首先耗材没有GQCE,也没有原研仿制定义,难以自然分层。目前常用的是按产地分组和价格分组,实际上并不直接体现质量指标。如果国家集采,需要考虑的综合因素很多,按国产进口不合乎政策导向,按价格分有极大的不合理性。按功能分则对质量评价没有任何体现,这种情况下势必需加强综合以上指标,但更科学合理的评价体系;
(我在之前的文章中也提到过,本次国家支架VBP所选产品范围较窄、国产替代完全、产品代际成熟。从技术角度讲具备了不分组的条件,但从耗材整体讲,必须要考虑和设计完善的质量评价方式。批准上市只是及格线,任何政府采购都应该考虑及格与满分之间的质量评价,但分不分层可能要看实际情况,选择帕加尼Zonda或法拉利Enzo的,质量因素就不如个性因素。)
三、 从日本的医疗器械定价方式探索质量分类
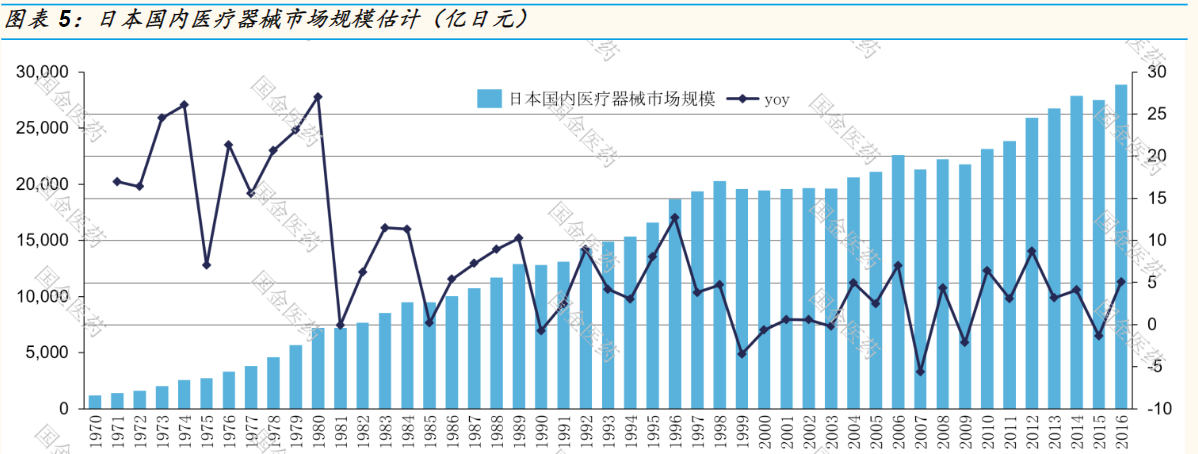
1、日本医疗器械市场与中国的很多相同的经历
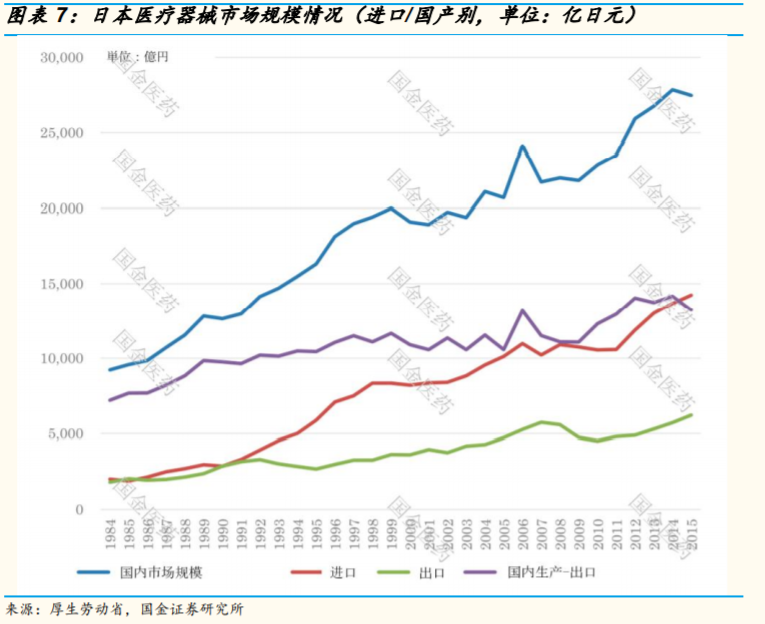
70 年代是日本医疗器械企业的高速增长期,十年均增长20%。进入80年代后,由于基数的扩大和行业的成熟,日本医疗器械市场增速逐步下降至个位数增速,但依然保持增长势头。整体规模从90年代初的12000亿日元左右,成长至00年前后20000亿左右。但这一时期,市场成长主要来自进口的继续增长。
2、日本控制费用的手段
日本医疗器械市场规模不断增大,且价格长期处于较高水平,对日本医保收支平衡产生了压力。日本随之建立了强力的控费机制,在医疗质量和经济效益之间寻求平衡。
1993年,日本建立了医疗器械功能分组报销制度,将医疗器械分为数百个功能类别按类别定价报销。2002 年引入外国平均价格FAP比较制度和每两年价格重新改订制度。在日本销售的医疗器械最终都通过日本的国家健康保险系统报销,不能获得报销资格基本意味着在日本无法有效销售,获得报销资格和理想的报销价格是企业头等大事。
日本按照STMD(Special Treatment Medical Devices)产品类别报销医疗器械(截至2018年5月31日,日本共认可1236种功能类别,涵盖约20000种不同的医疗器械和设备进行报销)。
STMD同一个功能分类均采用同一个报销价格。这些功能分类在结构、使用目的和临床疗效上相似。例如,冠状动脉支架有四个分类:一般、紧急治疗、再治疗约束(如药物涂层支架或 DES)和生物吸收/再增约束(如生物可耐性血管支架(BVS)。同时,特别改良作用的器械可以在其对应的报销类别之上享受额外加成。
日本STMD医疗器械主要报销类型分为A/B/C/F四类,其中A类和B类主要 针对相对成熟的医疗器械,而 C/F类主要针对较新的医疗器械。A类器材按技术服务报销,B类和C类则在技术收费之外,可以获得专门的产品报销。
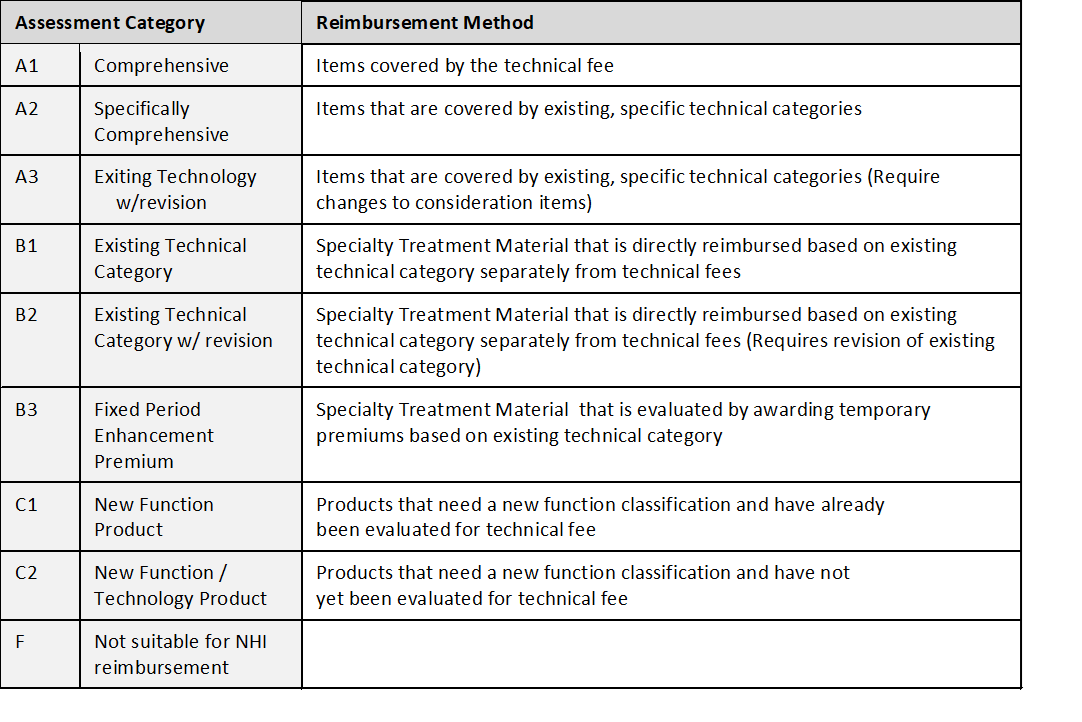

3、日本医疗器械报销申请及定价流程
公司获得新产品批准时,它会向厚生劳动省(MHLW)提交报销申请档案(HokenTekiyo Kibosho)。公司想要创建新的设备类别或技术费用时,他们需要提交C1或C2申请 。
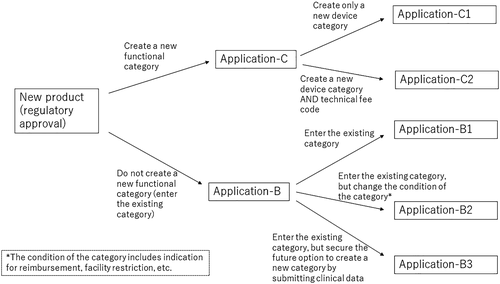
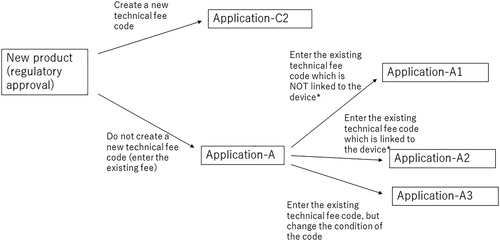
C1和C2应用的不同之处如下:C1是要建立STM设备新功能类别的方法,但在使用STM设备时,不收取技术费用(即新医疗耗材)。C2是新技术费用的申请,包括两个选项之一 1:同时请求新的 STM类别2的情况和仅请求技术费用的情况(即新医疗项目和新医疗耗材)。
新类别STM产品的价格设置规则:如果存在类似的类别,则使用类似的类别比较方法;如果没有,则使用成本核算方法。
创建新类别(STM)规则:在类似的功能类别比较方法中,存在几种溢价:划时代功能溢价(Kakkisei-kasan)、务实性溢价(Yuyosei-kasan)、改进溢价(Kairyo-kasan)和孤儿器械溢价(Shijosei-kasan);
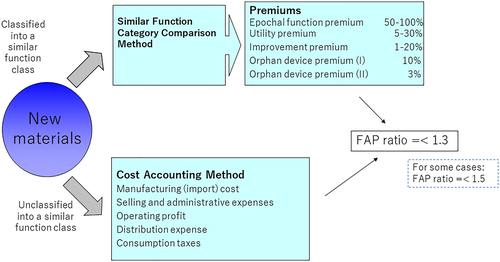
要达到划时代功能溢价,新产品必须满足三个条件:临床有效新结构、比现有效率/安全性更高、以及治疗方法的改进。对于务实性溢价,也应满足三个条件中的任何一个。对于改进溢价,应该存在一个渐进的改善方面,如降低患者的侵入性。(自2002年制定制度以来长达10年,只批准了一个划时代功能溢价案例,即2004年的DES。)
对于成本核算方法,报销价格按制造成本(进口成本)加上销售、管理费用以及其他相关费用计算;它基于预测的销售数量。
这两种方法定价是有上限的,上限是 FAP(Foreign Average Price)的1.3 倍(包括美国、英国、德国、法国和澳大利亚的价格;如果满足某些要求,上限可高达 FAP 的 1.5 倍)。这意味着,当FAP为100美元时,报销价格不能高于150 美元。
为了排除单一国家(如美国)过高的价格,当五国中最高价格超出最低价格 3 倍(2018年改为2.5倍)以上时,排除最高价;当次高价高于其他三者平均值2 倍(2018年改为1.8倍)时,将次高价降低至其他三者平均值2倍(1.8倍)参与计算。
(写到这,突然觉得我为药品 VBP熔断的1.8倍系数找到了理论依据啊~嘿嘿玩笑,相信是出于科学严谨的计算决策)
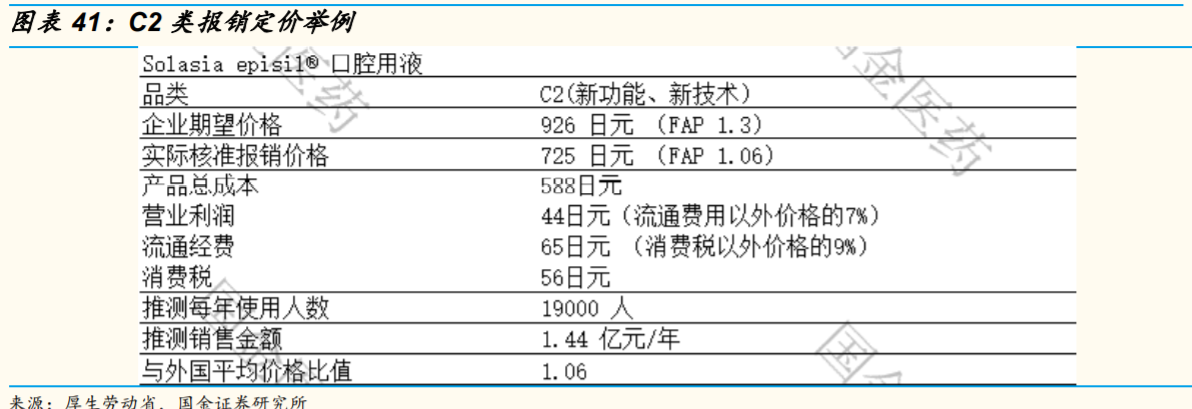
十年中创新评估结果看来,新设定的STM器械报销价格为FAP的0.95倍;自2008-2010年以来,这一值逐渐下降,从2008-2010年1.04倍,至2016-2018年0.88倍。
4、参考日本定价模式探索耗材质量评价方式
A. 依靠专业力量耐心做好耗材招标类型区分,参考日本器械 A/B/C/F的分类,将不符合VBP条件的(低值量小,挂网就好)、视为同质量的(如同B类,视同质量,基本一样,即同一个功能分类同一个价格)、以及必须区分质量的(同C1、C2类,质量评分,严肃认真)、做到几种招标类别分开,从而进行分类采购;(分类有压力但不是不能做,必竟日本都做了多年)。
B. 对需要集采的,确定好耗材招标细化目录,可以依照目前医保局的耗材代码为基础,继续细化区分结构、功能、等以适应集采;
C. 对同功能结构中必须区分质量产品,建立变异系数分组法,将:
临床有效新结构;(微创新)
比现有效率/安全性更高;(技术指标)
治疗方法的改进;
卫生经济评估结果等;(接受多种结果按重要性排序)
临床专家长期疗效评估;(在德国定义了医院和专家要求:每年至少进行 100 次关节整形髋部或膝盖关节手术,医院设施中至少两名主外科医生,其中至少一人专门从事关节外科的),除了疗效,也可对产品特性评价,如,支架中可以对柔顺,灵活,追踪,推送性,顺应性Visibility,Flexibility,Trackability,Pushbility,Compliance指标评价;
学术指南推荐度(有的国家评价体系中录入了 277 项质量等级指南,以协助确定对每个分类及其相关基本要素的质量级别状态的评估);
进口国产(印度最近规定医疗一次性用品和消耗品至少需要50%的当地量。此外,医疗电子设备、医院设备、手术器械必须至少具有25%的当地量);
集采地范围内,产品市场销量占比;
信用纪录评价;
目前产能等其它因素;
每一个因素赋予不同权重和系数,采取类似DRG中CV(Coefficient of Variation)变异系数的概念(变异系数是一个数据集的变异指标与其平均指标的比值, 其中最常用的是标准差,此时计算公式为 CV=标准差/均数)。将CV大于某值的产品给予单独分组。(当然这只是个想法,要细化每个指标,并建模来看可行性)。
如果质量评价数值成熟,甚至可以讨论用质量分与报价的百分比(性价比)来确定中标,而不仅仅看最低价。
这样的方式和墨西哥(中高收入国家)是相似的,通常将区域、有时是国家一级的购买需求,由每个社会保障机构重新组合,以增加购买力。这就是为什么墨西哥的采购过程是官方化和高度标准化的。
墨西哥法律提供了两种评估标准列表中列出的 HRMD 报价的选项:一是,百分比和分数或成本效益选择得分最高的 HRMD;二是,使用Binario评估在符合HRMD要求的那些选择最便宜的医疗设备。
5、国际研究结果中发现的一些其它建议
a) 可以加强集采后的效果评估和分享流程:
有研究表明,欧洲国家在审查使用金属对臀部或乳房植入后引起的术后问题时,欧洲国家发病率上升,这引起了管理机构的关注,促使欧盟在产品上市之前重新定义了 CE 标志要求。而墨西哥联邦卫生与公众服务部(COFEPRIS)的技术监查部(COFEPRIS)记录了HRMD投诉,记录了不良事件(例如金属碎片对骨骼反应造成损害;骨水泥未充分附着在水泥植入物表面),但只由医生或医疗器械供应商报告。然而CONAMED 和 COFEPRIS 没有流程来分享和相互学习这些投诉。
b) 国内外企业公平参与,进行法律明确:
日本公共部门采购医疗技术产品和服务有关的措施中,明确了政府将给予外国产品和服务和外国供应商的待遇不低于其给予:(1)国内产品、服务和供应商;和(2)其它外国产品、服务和供应商。政府不会:(l)根据外国从属关系或所有权程度,对当地建立的供应商比另一个当地建立的供应商更不利;或(2)歧视当地建立的供应商,因为该供应商为特定采购提供的产品或服务是外国产品或服务。
*部分图片来自于网络,如有侵权请联系客服删除。


